Forschungsprojekt 1
Dreijähriges DFG-Projekt, voraussichtlicher Beginn Juli 2017
Biologicic and therapeutic impact of the AKT1E17K mutation in meningiomas
Project description in English
Meningiomas are frequent intracranial tumours, in which a significant proportion of patients may benefit from pharmacological treatment in addition to surgery and irradiation, especially in aggressive meningioma subtypes. However, so far no treatment scheme has been proven to be effective. Our group has recently demonstrated in vitro and in vivo that mTORC1 inhibitors represent an effective meningioma treatment option.
The role of genetic factors for biologic aggressiveness and chemosensitivity of meningiomas is not well defined. This applies even to the tumour suppressor NF2 (merlin), despite the high frequency of functional losses of this gene. Recently, the oncogenic mutation E17K in the AKT1 gene (AKT1E17K), which leads to a constitutive activation of this kinase, has been identified as a somatic mutation in a fraction of meningiomas without NF2 loss, suggesting an independent AKT1-driven tumor-promoting pathway. This constitutive activation of AKT1 is highly interesting, because AKT1 interacts bidirectionally with two mTOR-complexes and can be expected to modify mTOR-associated growth regulation and chemosensitivity.
In the project, we intend to analyze a) the role of AKT1E17K for the regulation of mTOR-complexes and mTOR-dependent features of meningioma cells, i.e. proliferation, adhesion, migration, invasion, colony formation and chemosensitivity in vitro, b) in mouse models the impact of AKT1E17K for tumorigenicity and growth kinetics of malignant meningiomas in tumor-bearing mice, and c) the response of the latter parameters in vivo towards inhibitors of AKT1, of mTORC-complex 1 or dual inhibitors of mTORC1/2. The in vitro studies will be based upon syngenic cell lines expressing mutated and wild type AKT1. In vivo experiments will include intracranial xenografts of human tumor cells and a genetically induced mouse meningioma model. The latter will show meningeal expression of AKT1E17K or AKT1-wt. It’s construction (in cooperation with Michel Kalamarides, Paris and Guiseppe Viglietto, Catanzaro, Italy) at first requires existing mouse strains, which contain in all cells the appropriate AKT1 transgene, silenced by a floxed transcriptional stop signal (tpa). They will be crossed with Cre driver mice, which express Cre under the control of the meningeal-specific prostaglandin-D2-synthase (PGDS) promoter.
Projektbeschreibung in Deutsch
Meningeome sind häufige intrakranielle Tumore. Ein hoher Anteil der Patienten würde möglicherweise von einer pharmakologischen Behandlung profitieren als Zusatz zu Chirurgie und Bestrahlung, besonders im Falle der aggressiven Meningeom-Subtypen. Bislang wurde jedoch keine effektive Behandlungsoption gefunden. Unsere Arbeitsgruppe hat kürzlich in vitro und in vivo gezeigt, dass mTPRC1-Inhibitoren eine effektive Behandlungsoption darstellen.
Die Rolle genetischer Faktoren für biologische Aggressivität und Chemosensitivität von Meningeomen ist nicht gut verstanden. Dies schließt sogar den Tumorsuppressor NF2 (Merlin) ein, trotz seines häufigen Funktionsverlustes in Meningeomen, der seit langem bekannt ist. In jüngerer Zeit wurde die onkogene Mutation E17K im Gen AKT1 (AKT1E17K), die zu einer konstitutiven Aktivität dieser Kinase führt, in einem Teil der Meningeome ohne NF2-Verlust identifiziert, was auf eine unabhängige, AKT1-getriebene Tumorgenese hindeutet. Diese konstitutive Aktivität von AKT1 ist von hohem Interesse, weil AKT1 bidirektional mit zwei mTOR-Komplexen interagiert und daher vermutlich die mTOR-assoziierte Wachstumsregulation und Chemosensitivität beeinflusst.
Im Projekt möchten wir analysieren a) die Rolle von AKT1E17K für die Regulation von mTOR-Komplexen und mTOR-abhängigen Eigenschaften von Meningeomzellen, d.h. Proliferation, Adhäsion, Migration, Invasion, Koloniebildung und Chemosensitivität in vitro, b) in Mausmodellen die Bedeutung von AKT1E17K für Tumorigenität und Wachstumskinetik maligner Meningeome in Tumor-tragenden Mäusen, und c) die Antwort der letztgenannten Parameter in vivo gegenüber Inhibitoren von AKT1, mTOR-Komplex 1 oder dualer Inhibitoren von mTORC1/2. Die in vitro Studien werden auf syngenen Zellen basieren, die mutiertes oder Wildtyp AKT1 exprimieren. Die in vivo Experimente werden intrakranielle Xeno-Transplantate humaner Tumorzellen einschließen sowie ein genetisch induziertes Maus-Meningeommodell. Das letztere wird eine meningeale Expression von AKT1E17K oder AKT1-wt aufweisen. Seine Konstruktion (in Zusammenarbeit mit Michel Kalamarides, Paris und Guiseppe Viglietto, Catanzaro, Italien) erfordert zunächst bereits existierende Mausstämme, die in allen Zellen das entsprechende AKT1-Transgen enthalten, jedoch abgeschaltet durch ein gefloxtes transkriptionales Stop-Signal (tpa). Diese werden gekreuzt mit Cre-Treibermäusen, die Cre exprimieren unter der Kontrolle des Meningen-spezifischen Promoters der Prostaglandin-D2-Synthase (PGDS).
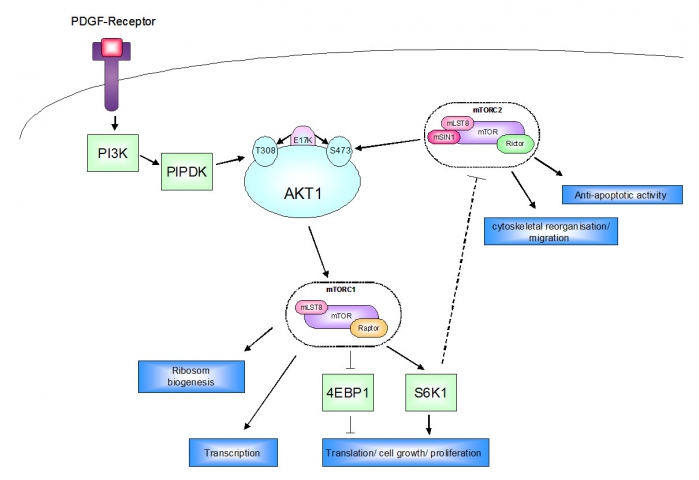
Molecular interactions between AKT1 and mTORC1 /mTORC2 (modified from23)
PDGF = platelet derived growth factor, PI3K = phosphoinositid-3-kinase, PIPDK = phosphoinositid dependent kinase





